Скачати цей тест
Всі тести у форматі PDF, презентації та Word документи для підготовки та викладання
Дізнатися більше
Двохатомний газ перебуває в камері під тиском $p_{0}$. Коли абсолютну температуру газу збільшили в 3 рази, відбулася повна дисоціація його молекул – усі вони розпалися на атоми. Яким став після цього тиск газу? Уважайте, що об'єм камери залишається сталим.
Г
$6 p_{0}$
Правильна відповідь
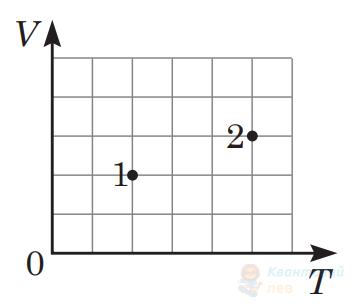
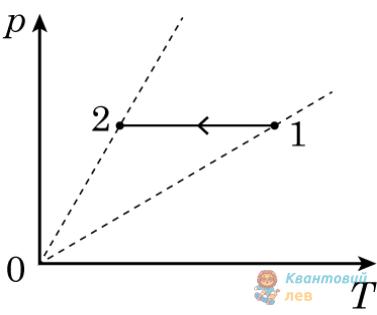
Укажіть рівність, яка встановлює правильне співвідношення між тисками $p_{1}$ та $p_{2}$ ідеального газу в станах 1 і 2 (див. рисунок) у системі координат $V T$, де $V$ – об'єм, $T$ – абсолютна температура. Маса газу стала.
А
$p_{2}=\frac{2}{5} p_{1}$
Б
$p_{2}=\frac{3}{2} p_{1}$
В
$p_{2}=\frac{5}{3} p_{1}$
Правильна відповідь
Г
$p_{2}=\frac{5}{2} p_{1}$
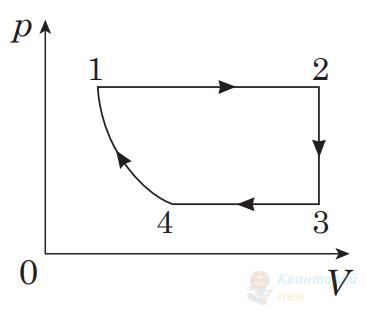
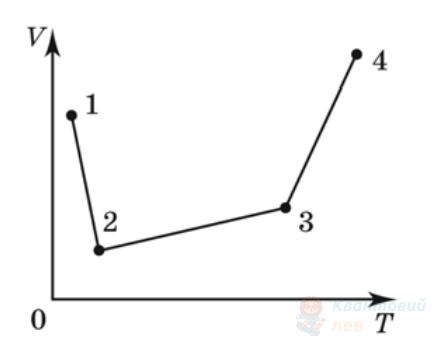
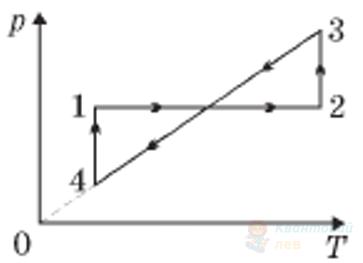
На рисунку в координатах $p V$ зображено замкнутий цикл 12341, здійснений газом незмінної маси (лінія 41 – частина гіперболи). Визначте вигляд цього циклу в координатах $p T$ ( $p$ – тиск, $T$ – температура, $V$ – об'єм).
А
 Правильна відповідь
Правильна відповідь
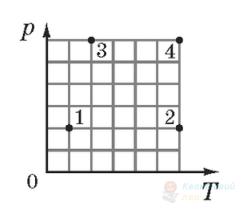
На кожному з чотирьох рисунків у координатах $V T$ (де $V$ – об'єм, $T$ – абсолютна температура) зображено точку (А – Г), координати якої відповідають параметрам стану ідеального газу кількістю речовини 1 моль. Яка точка відповідає стану газу з найбільшим тиском?
В
 Правильна відповідь
Правильна відповідь
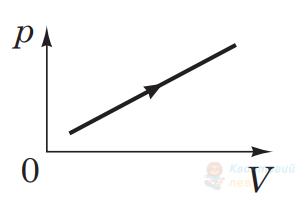
Визначте, як змінюються термодинамічні параметри (об'єм $V$, абсолютна температура $T$, тиск $p$ ) ідеального газу незмінної маси під час процесу, графік якого наведено на рисунку.
А
$V, T, p$ збільшуються
Правильна відповідь
Б
$V, p$ збільшуються, $T$ не змінюється
В
$T, p$ збільшуються, $V$ зменшується
Г
$V, p$ збільшуються, $T$ зменшується
Газ стискають у посудині з рухомим поршнем. Укажіть графік, який правильно відображає залежність концентрації молекул газу від об'єму (кількості молекул в одиниці об'єму).
А
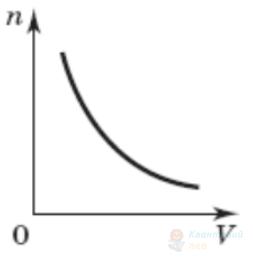 Правильна відповідь
Правильна відповідь
Унаслідок підвищення абсолютної температури газу в закритому балоні в 3 рази кожна друга молекула розпалася на 2 атоми. Визначте, у скільки разів збільшився тиск газу.
В
у 4,5 раза
Правильна відповідь
Точки на рисунку відповідають різним станам однієї й тієї самої маси ідеального газу ( $p$ – тиск, $T$ – температура). У якому стані об'єм газу найбільший?
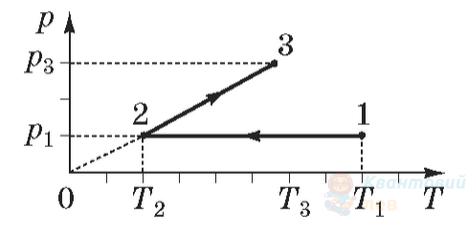
На рисунку зображено графік зміни стану ідеального газу в координатах $p T$, де $p$ – тиск, $T$-температура. Маса газу – стала. За графіком визначте, який об'єм займав газ у стані 1, якщо після закінчення процесів, відображених на графіку, об'єм газу становив $12 \mathrm{~л}$.
Г
$48 \mathrm{~л}$
Правильна відповідь
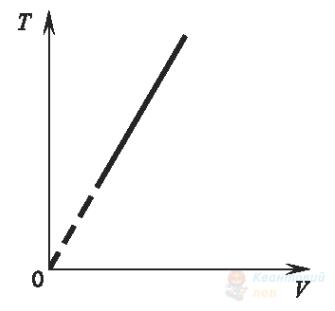
На рисунку зображено графік залежності абсолютної температури ідеального газу від його об’єму. Виберіть рисунок, на якому зображено графік цього процесу в системі інших термодинамічних координат.
В
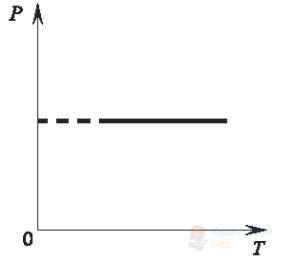 Правильна відповідь
Правильна відповідь
У посудині, закритій рухомим поршнем, знаходиться ідеальний газ. На рисунку зображено залежність об'єму газу від абсолютної температури. У якому стані тиск газу найбільший?
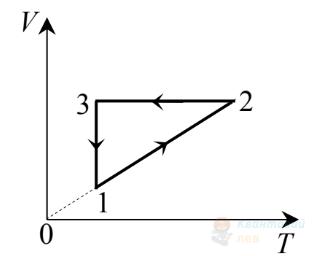
На рисунку в системі координат $V, T$ зображено замкнутий цикл 1231, здійснений газом сталої маси. Визначте, який вигляд має графік цього циклу в системі координат $p, V$.
В
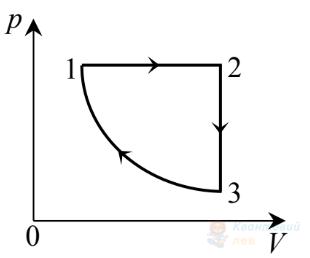 Правильна відповідь
Правильна відповідь
Початковий об'єм газу становить $60 \mathrm{~л}$. Визначте, яким стане об'єм цієї маси газу, якщо абсолютна температура підвищиться від $300 \mathrm{~К}$ до $450 \mathrm{~К}$, а тиск зменшиться в 2 рази.
Г
$180 \mathrm{~л}$
Правильна відповідь
Визначте, якою буде абсолютна температура певної маси ідеального газу, якщо тиск газу збільшити на $25 \%$, а об'єм зменшити на $20 \%$. Початкова температура газу дорівнює $300 \mathrm{~К}$.
Б
$300 \mathrm{~К}$
Правильна відповідь
У балоні знаходилося $0,3 \mathrm{~кг}$ гелію. Через деякий час у результаті витоку гелію та зменшення абсолютної температури на $10 \%$ тиск у балоні зменшився на $20 \%$. Визначте, скільки молекул гелію просочилося з балона. $N_{\mathrm{A}} = 6 \cdot 10^{-23} \mathrm{~моль}^{-1}$; молярна маса гелію дорівнює $4 \cdot 10^{-3} \mathrm{~кг} / \mathrm{моль}$.
В
$5 \cdot 10^{24}$
Правильна відповідь
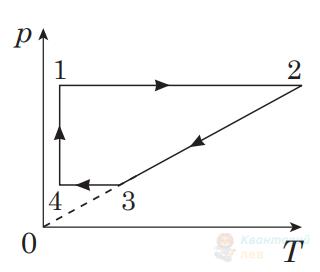
На рисунку в системі координат $p, T$ зображено замкнутий цикл 12341, здійснений газом сталої маси. Установіть, який вигляд має графік цього циклу в системі координат $V, T$.
А
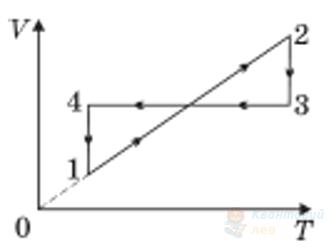 Правильна відповідь
Правильна відповідь
У балоні знаходилося $0,3 \mathrm{~кг}$ гелію. Через деякий час у результаті витоку гелію та зменшення абсолютної температури на $10\ \%$ тиск у балоні зменшився. Визначте, на скільки відсотків зменшився тиск у балоні, якщо відомо, що назовні з балона просочилося $5 \cdot 10^{24}$ молекул. $N_{\mathrm{A}} = 6 \cdot 10^{-23} \mathrm{~моль}^{-1}$; молярна маса гелію дорівнює $4 \cdot 10^{-3} \mathrm{~кг} / \mathrm{моль}$.
Б
$20\ \%$
Правильна відповідь
На рисунку зображено графік залежності тиску $\large p$ ідеального газу сталої маси від абсолютної температури $T$.
Як змінились об'єм газу й середня квадратична швидкість руху його молекул під час переходу зі стану 1 у стан 2?
Б
зменшився; зменшилася
Правильна відповідь
Балон об'ємом $0,83 \mathrm{~м}^{3}$ за температури $250 \mathrm{~К}$ під тиском $100 \mathrm{~кПа}$ заповнено киснем. Після того як у балон додали ще кисню, тиск газу збільшився до $195 \mathrm{~кПа}$, а його температура – до $300 \mathrm{~К}$. Уважайте, що молярна маса кисню $32 \mathrm{~г}/\mathrm{моль}$, а універсальна газова стала дорівнює $8,3 \mathrm{~Дж}/(\mathrm{моль} \cdot \mathrm{К})$.
Обчисліть кількість речовини в балоні перед додаванням кисню.
Відповідь запишіть у молях ($\mathrm{моль}$).
Правильна відповідь:
40.0
Балон об'ємом $0,83 \mathrm{~м}^{3}$ за температури $250 \mathrm{~К}$ під тиском $100 \mathrm{~кПа}$ заповнено киснем. Після того як у балон додали ще кисню, тиск газу збільшився до $195 \mathrm{~кПа}$, а його температура – до $300 \mathrm{~К}$. Уважайте, що молярна маса кисню $32 \mathrm{~г}/\mathrm{моль}$, а універсальна газова стала дорівнює $8,3 \mathrm{~Дж}/(\mathrm{моль} \cdot \mathrm{К})$.
Обчисліть масу кисню, який додали в балон.
Відповідь запишіть у кілограмах ($\mathrm{кг}$).
У кімнаті ввімкнули опалення. Температура повітря підвищилася від $18^{\circ} \mathrm{C}$ до $27^{\circ} \mathrm{C}$ за незмінного атмосферного тиску. Визначте, на скільки відсотків зменшилася кількість молекул газів повітря в кімнаті. Уважайте, що $0^{\circ} \mathrm{C}$ відповідає $273 \mathrm{~К}$.
В автомобільному газовому балоні із метаном $\left(\mathrm{CH}_{4}\right)$ місткістю $83 \mathrm{~л}$ тиск дорівнює $150 \mathrm{~атм}$ , температура становить $27^{\circ} \mathrm{C}$. Визначте кількість теплоти, що виділиться внаслідок згоряння всього метану, якщо питома теплота його згоряння $50 \mathrm{~МДж} / \mathrm{кг}$. Уважайте, що універсальна газова стала дорівнює $8,3 \mathrm{~Дж} / ( \mathrm{моль} \cdot \mathrm{К} )$, а одна атмосфера становить $10^{5} \mathrm{~Па}$. Молярна маса метану $\left(\mathrm{CH}_{4}\right)$ дорівнює $16 \mathrm{~г}/\mathrm{моль}$. Відповідь запишіть у мегаджоулях.
Правильна відповідь:
400.0
Визначте кількість речовини газу, якщо за температури $7^{\circ} \mathrm{C}$ і тиску $166 \mathrm{~кПа}$ об'єм газу дорівнює $70 \mathrm{~л}$. Уважайте, що універсальна газова стала дорівнює $8,3 \mathrm{~Дж}/(\mathrm{моль} \cdot \mathrm{К})$.
Відповідь запишіть у молях
У посудину об'ємом $0,83 \mathrm{~м}^{3}$ налили воду. Потім посудину герметично закрили та нагріли воду до температури $100^{\circ} \mathrm{C}$. Уся вода випарувалася й створила тиск $10^{5} \mathrm{~Па}$. Уважайте, що молярна маса води дорівнює $18 \cdot 10^{-3} \mathrm{~кг}/\mathrm{моль}$, універсальна газова стала становить $8,3 \mathrm{~Дж} / ( \mathrm{моль} \cdot \mathrm{К} )$.
Визначте масу води, яку налили в посудину.
Відповідь запишіть у кілограмах ($\mathrm{кг}$) і округліть до сотих.
Правильна відповідь:
0.48
Футбольний м'яч об'ємом $3 \mathrm{~л}$ накачують поршневим насосом до тиску $2 \cdot 10^{5} \mathrm{~Па}$. Скільки накачувань потрібно зробити, якщо за кожне накачування до м'яча надходить повітря об'ємом $300 \mathrm{~см}^{3}$ ? Уважайте, що атмосферний тиск становить $1 \cdot 10^{5} \mathrm{~Па}$.
Правильна відповідь:
10.0
Кисень знаходиться в балоні під тиском $2,075 \cdot 10^{5} \mathrm{~Па}$. Температура в балоні дорівнює $47^{\circ} \mathrm{C}$. Яку густину має кисень? Молярна маса кисню становить $0,032 \mathrm{~кг}/\mathrm{моль}$; універсальна газова стала дорівнює $8,3 \mathrm{~Дж} / ( \mathrm{моль} \cdot \mathrm{К} )$. Відповідь запишіть у $\mathrm{кг} / \mathrm{м}^{3}$.
Циліндрична закрита посудина висотою $1,2 \mathrm{~м}$ знаходиться у вертикальному положенні і розділена на дві частини невагомим тонким поршнем, що ковзає без тертя. На якій висоті установиться поршень, якщо у верхній частині посудини знаходиться гелій, молярна маса якого дорівнює $0,004 \mathrm{~кг}/\mathrm{моль}$, а у нижній – азот, молярна маса якого $0,028 \mathrm{~кг}/\mathrm{моль}$. Температури і маси газів в обох частинах посудини однакові. Відповідь запишіть у метрах.
Правильна відповідь:
0.15
Ідеальний одноатомний газ знаходиться в посудині з твердими стінками об'ємом $0,5 \mathrm{~м}^{3}$. Унаслідок нагрівання його тиск збільшився на $6 \cdot 10^{3} \mathrm{~Па}$. На скільки збільшилася внутрішня енергія газу? Відповідь запишіть у кілоджоулях.
Для різання металу з газового балона місткістю $83 \mathrm{~л}$ і робочим тиском 70 атм використано кисень масою $2 \mathrm{~кг}$. Яка маса ($\mathrm{кг}$) кисню, що залишився в балоні? Температура газу в балоні становить $7^{\circ} \mathrm{C}$. Уважайте, що універсальна газова стала дорівнює $8,3 \mathrm{~Дж} / ( \mathrm{моль} \cdot \mathrm{К} )$, молярна маса кисню – $0,032 \mathrm{~кг}/\mathrm{моль}$, 1 атм $=10^{5} \mathrm{~Па}$.
Повітряна куля з газонепроникною оболонкою масою $400 \mathrm{~кг}$ заповнена гелієм. Куля може нерухомо утримувати вантаж масою $225 \mathrm{~кг}$ у повітрі на певній висоті. Визначте масу гелію в кулі. Вважайте, що об'єм вантажу малий, а оболонка кулі не спричиняє опору зміні об'єму кулі і є тонкою. Молярна маса гелію дорівнює $4 \cdot 10^{-3} \mathrm{~кг} / \mathrm{моль}$. Повітря вважайте газом з молярною масою $29 \cdot 10^{-3} \mathrm{~кг} / \mathrm{моль}$. Гелій і повітря вважайте ідеальними газами. Відповідь запишіть у кілограмах.
Правильна відповідь:
100.0
Визначте густину водню за температури $27^{\circ}\mathrm{C}$ й тиску $2,49 \cdot 10^{5} \mathrm{~Па}$. Молярна маса водню становить $2 \cdot 10^{-3} \mathrm{~кг} / \mathrm{моль}$.
Універсальна газова стала дорівнює $8,3 \mathrm{~Дж} / ( \mathrm{моль} \cdot \mathrm{К} )$. Уважайте водень за цих умов ідеальним газом.
Відповідь запишіть у кілограмах на метр кубічний ($\mathrm{кг} / \mathrm{м}^3$).